Обновления в 2022 году
В условиях ограничительных мер экономического характера, введенных в отношении Российской Федерации, Правительство РФ упростило государственную регистрацию медицинских изделий, в отношении которых может возникнуть или уже возникла дефектура (отсутствие в свободном доступе необходимой продукции. Порядок упрощенной регистрации таких изделий регулируется Постановлением Правительства РФ №552 от 01.04.2022 г. Вы можете ознакомиться с новой процедурой.
Упрощенная регистрация медицинских изделий
19 марта 2020 года был введен особый порядок регистрации некоторых видов медицинских изделий, необходимых для предупреждения распространения инфекционных заболеваний. Упрощение процедуры регламентировано Постановлением Правительства № 299 от 18 марта 2020 г.
Правительство Российской Федерации упростило процедуру регистрации для 36 наименований медизделий – респираторов, медицинских масок, изолирующих халатов и костюмов, а также перчаток и бахил. Итоговый документ, регистрационное удостоверение, на данную продукцию ранее оформлялось в течении 3-5 месяцев. Теперь же, Росздравнадзор будет принимать решение о регистрации медицинских изделий, включенных в перечень, в течение трех-пяти рабочих дней дней после поступления первичного пакета документов. Далее уже потребуется в течении 150 дней довезти полный комплект документов.
Росздравнадзор опубликовал методические рекомендации по регистрации медицинских изделий с низкой степенью потенциального риска их применения.
Дополнительные меры по упрощению введены временно с 6 апреля 2020 г. Постановлением Правительства № 430 от 03 апреля 2020 года «Особенности обращения медицинских изделий, в том числе государственной регистрации серии (партии) медицинских изделий».
Этим постановлением введен еще один вариант упрощенной регистрации (для продукции указанной в перечне приложенном к постановлению). В случае применения данного способа Регистрационное удостоверение действует до 1 января 2020 года, присутствует возможность регистрации партии медицинских изделий, признании иностранных протоколов испытаний.
Также допускается ввоз незарегистрированных медицинских изделий для проведения испытаний без получения разрешения на временной ввоз (единичные экземпляры).
Допускается реализация не зарегистрированных в Российской Федерации медицинских изделий одноразового использования по перечню, предусмотренному приложением к настоящему документу, без получения разрешения Федеральной службы по надзору в сфере здравоохранения, если указанные изделия зарегистрированы в установленном порядке в стране-производителе.
В перечень к ПП 430 вошли аппараты искусственной вентиляции лёгких (аппарат ИВЛ) разных видов, оксигенаторы, перчатки, костюмы изолюрующие, халаты медицинские, маски разных видов, термометры и т.д. (рекомендуем ознакомиться с полным перечнем отраженным в постановлении).
Однако вместе с упрощением, введенным указанным выше постановление, введены ограничительные меры Постановлением Правительства № 433 от 03 апреля 2020 года по продаже изделий для предотвращения заражения и производных (маски, респираторы, перчатки медицинские, марля) на 90 дней.
Пояснения к ПП 430 и 433
На сайте ФГБУ «Национального института качества» Росздравнадзора размещена ПАМЯТКА заявителям для подачи документов с целью государственной регистрации серии (партии) медицинского изделия в соответствии с постановлением Правительства Российской Федерации от 03.04.2020 № 430
Итого была упрощена процедура получения регистрационного удостоверения на:
1. Костюм изолирующий
2. Перчатки смотровые/процедурные из латекса гевеи,
неопудренные, нестерильные
3. Перчатки смотровые/процедурные из латекса гевеи,
опудренные
4. Халат операционный одноразового использования
5. Халат операционный многоразового использования
6. Халат изолирующий многоразового использования
7. Халат изолирующий одноразового использования
8. Маска лицевая для защиты дыхательных путей
многоразового использования
9. Перчатки смотровые/процедурные из полихлоропрена,
неопудренные
10. Перчатки смотровые/процедурные из полихлоропрена,
опудренные
11. Бахилы токонепроводящие, нестерильные
12. Халат для пациента одноразового использования
13. Халат для пациента многоразового использования
14. Халат процедурный одноразового использования
15. Халат процедурный многоразового использования
16. Респиратор общего применения
17. Костюм хирургический изолирующий
18. Маска хирургическая многоразового использования
22. Перчатки смотровые/процедурные нитриловые,
опудренные
23. Костюм хирургический на манжетах
24. Перчатки смотровые/процедурные виниловые,
неопудренные
25. Перчатки смотровые/процедурные виниловые,
опудренные
26. Костюм хирургический одноразового использования,
нестерильный
27. Бахилы водонепроницаемые
28. Бахилы токопроводящие, нестерильные
29. Перчатки смотровые/процедурные из гваюлового
латекса, неопудренные
30. Перчатки смотровые/процедурные из
этиленвинилацетата, неопудренные, нестерильные
31. Перчатки смотровые/процедурные нитриловые,
неопудренные, антибактериальные
32. Перчатки смотровые/процедурные полиизопреновые,
неопудренные
33. Набор одежды хирургический/смотровой
34. Перчатки смотровые/процедурные полиизопреновые,
опудренные
35. Перчатки смотровые/процедурные из латекса гевеи,
неопудренные, нестерильные, антибактериальные
36. Маска лицевая для защиты дыхательных путей
одноразового использования
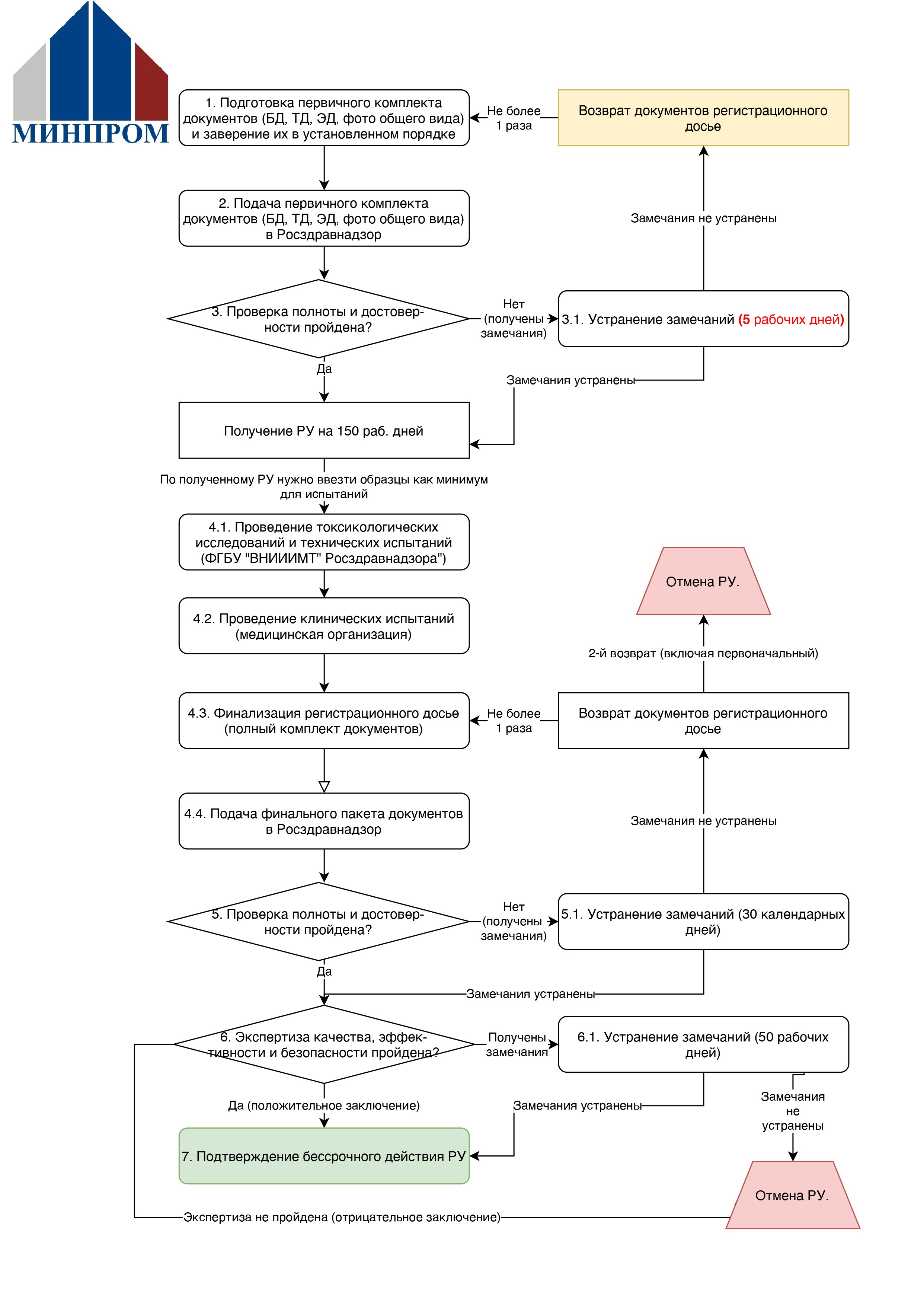
Процесс упрощенной регистрации
1) Подготавливается комплект базовых (юридических) документов, техническая и эксплуатационная документация, фото общего вида.
2) Данный пакет документов подается в Росздравнадзор.
3) Производится проверка полноты и достоверности, по результатам которой может выйти уведомление об устранении нарушений (необходимо устранить в течение 5 рабочих дней) или РУ.
4) В течение 150 рабочих дней во избежание аннулирования РУ необходимо провести токсикологические исследования, технические испытания, клинические испытания, доработать, при необходимости, техническую и эксплуатационную документацию, и подать пакет документов в Росздравнадзор.
5) Росздравнадзор проводит проверку полноты и достоверности, по результатам которой может выйти уведомление об устранении нарушений (необходимо устранить в течение 30 календарных дней) или направление в экспертное учреждение.
6) Экспертное учреждение проводит экспертизу в стандартном порядке (аналогично процедуре экспертизы при обычной регистрации медицинских изделий 1-го класса риска), по результатам которой выходит положительное заключение, замечания (необходимо устранить в течение 50 раб. дней) или отрицательное заключение (влечет отмену государственной регистрации и необходимость регистрации по стандартной процедуре.
7) После положительного заключения РУ продолжает действовать бессрочно.
Какие документы необходимы для оформления РУ
При регистрации медицинского изделия потребуется доверенность
Итого минимальный комплект документов требуемый для оформления составляет:
а) копия документа, подтверждающего полномочия
уполномоченного представителя производителя (изготовителя) (для иностранного изготовителя);
б) техническая документация производителя (изготовителя)
на медицинское изделие (для российского изготовителя разрабатываются Технические условия в соответствии с ГОСТ Р 1.3-2018 Технические условия на продукцию (общие требования к содержанию, оформлению, обозначению и обновлению));
в) эксплуатационная документация производителя (изготовителя)
на медицинское изделие, в том числе инструкция по применению
или руководство по эксплуатации медицинского изделия; (должны соответствовать требованиям Приказа Министерства здравоохранения РФ от 19 января 2017 г. N 11н «Об утверждении требований к содержанию технической и эксплуатационной документации производителя (изготовителя) медицинского изделия»)
г) фотографические изображения общего вида медицинского
изделия вместе с принадлежностями, необходимыми для применения
медицинского изделия по назначению (размером не менее
18 на 24 сантиметра);
д) опись документов.
В дальнейшем потребуется довезти (в течении 150 дней):
а) копия документа, подтверждающего полномочия
уполномоченного представителя производителя (изготовителя);
б) сведения о нормативной документации на медицинское изделие;
в) документы, указанные в подпунктах «б», «в» и «г» пункта 572
настоящих Правил (в случае внесения в них изменения
по результатам проведенных испытаний (исследований) медицинского
изделия);
г) документы, подтверждающие результаты технических испытаний
медицинского изделия, выданные федеральным государственным
бюджетным учреждением «Всероссийский научно-исследовательский
и испытательный институт медицинской техники» Федеральной службы
по надзору в сфере здравоохранения (далее — учреждение);
д) документы, подтверждающие результаты токсикологических
исследований медицинского изделия, использование которого
предполагает наличие контакта с организмом человека, выданные
учреждением;
е) документы, подтверждающие результаты испытаний
медицинского изделия в целях утверждения типа средств измерений
(в отношении медицинских изделий, относящихся к средствам измерений,
в сфере государственного регулирования обеспечения единства
измерений, перечень которых утверждается Министерством
здравоохранения Российской Федерации), выданные учреждением;
ж) документы, подтверждающие результаты клинических испытаний
медицинского изделия, проведенных в медицинской организации
государственной системы здравоохранения, отвечающей требованиям,
утвержденным Министерством здравоохранения Российской Федерации;
з) копии документов, подтверждающих качество лекарственного
препарата, фармацевтической субстанции, биологического материала
и иного вещества, с использованием которых произведено медицинское
изделие или которые входят в его состав и предназначены для применения
только с учетом назначения медицинского изделия, определенного
производителем, и выданных в соответствии с законодательством страны
происхождения лекарственного препарата, фармацевтической субстанции,
биологического материала и иного вещества;
и) оригинал регистрационного удостоверения;
Услуги и преимущества нашей компании
- Имеющийся опыт в оформления Регистрационных удостоверений, поможет дать вам профессиональную консультацию по каждому вопросу, касающемуся нотификации и ее оформления.
- Мы оформляем протоколы испытаний только в аккредитованных лабораториях. Полный перечень лабораторий по категориям испытаний Вы можете найти на сайте Росздравнадзора.
- Помощь в подготовке подаче документации в Росздравнадзор.
- Все обсуждения с органами занимающимися оформлением Регистрационных удостоверений, а так же отслеживания всего процесса получения РУ, решение спорных вопросов наша компания берет всецело на себя.
Сумма пошлин:
| Наименование услуги | Стоимость |
|---|---|
| За государственную регистрацию медицинских изделий | 7000 рублей |
| За внесение изменений в регистрационное удостоверение на медицинское изделие | 1 500 рублей |
| За выдачу дубликата регистрационного удостоверения на медицинское изделие | 1 500 рублей |
| За проведение экспертизы качества, эффективности и безопасности медицинских изделий (1 класса потенциального риска) |
класс 1 — 45 000 рублей |
Сроки: от 5 дней
Задать интересующие Вас вопросы и заказать услугу вы можете по телефону +7 (495) 723-23-71 или по электронной почте info@minprom.ru

